Memahami Konfigurasi Elektron | Ini Pengertian, Jenis, dan Cara Menentukannya
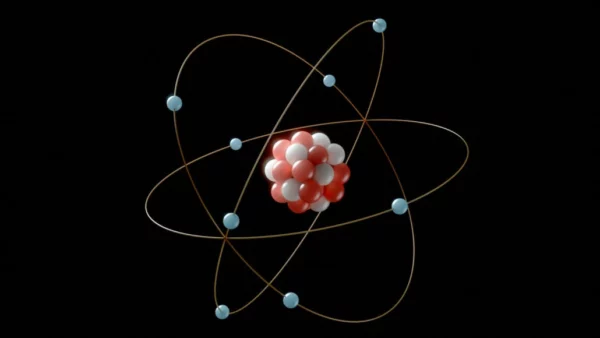
Cari tahu pengertian, jenis, dan cara menentukan konfigurasi elektron!
Apakah kamu pernah mendengar istilah konfigurasi elektron? Ini sering kali berkaitan dengan alat komunikasi modern dan fungsinya, lho.
Jika belum pernah dengar, kalian harus tahu bahwa hal ini adalah dasar dalam mempelajari kimia. Konfigurasi elektron dapat membantu kita untuk memahami bagaimana suatu atom berinteraksi dengan atom lain dan juga mengapa mereka memiliki sifat-sifat yang berbeda-beda.
Tidak hanya itu, dalam artikel kali ini, kita akan belajar tentang pengertian dari konfigurasi elektron dan juga cara menentukannya. Yuk, simak selengkapnya!
Baca juga: 8 Jurusan Kuliah Gampang Cari Kerja | Masa Depan Pasti Cerah
Pengertian Konfigurasi Elektron

Konfigurasi elektron adalah susunan elektron dalam orbital atom. Konfigurasi elektron bisa kamu identifikasi dengan menentukan kompleksi subshell dan nomor orbitalnya.
Orbital elektron terbagi ke dalam beberapa kategori, yaitu: s, p, d, dan f. Semua kategori orbital memiliki arah yang berbeda-beda. Orbital s adalah orbital dengan arah radial simetris (tegak), sedangkan orbital p memiliki arah radial asimetris (miring). Kedua jenis orbital ini termasuk ke dalam subshell 1s dan 2s.
Berikutnya adalah orbital 3d dan 4f. Orbital ini lebih rumit karena memiliki arah yang lebih kompleks. Orbital 3d termasuk ke dalam subshell 3d, sedangkan orbital 4f termasuk ke dalam subshell 4f.
Nomor atom merupakan indeks bagi seluruh orbital diatom. Sebagai contoh, nomor atom bagi orbital 3d tertentu adalah 3, sedangkan nomor atom bagi orbital 4f tertentu adalah 4.
Konfigurasi elektron dapat berarti susunan orbital diatom dan persebaran elektron di antaranya. Konfigurasi ini membantu kita untuk memahami perilaku atom-atom dan menemukan ikatan kimia yang terdapat di antara mereka.
Baca juga: 10 Jurusan Kuliah yang Prospek Kerjanya Bagus untuk Wanita
Jenis Konfigurasi Elektron
Nah, ada beberapa jenis konfigurasi elektron, nih, misalnya Bohr dan Kuantum.

Konfigurasi Kulit (Bohr)
Niels Bohr, ilmuwan penemu teori ini, berpendapat kalau elektron akan berputar mengelilingi inti pada lintasan dengan tingkat energi yang berbeda-beda. Lintasan ini memiliki sebutan kulit atom.
Nah, teori ini mengatakan kalau elektron harus berisi energi dari tingkat terendah, misalnya kulit K (n = 1), kemudian kulit L (n = 2), lalu M (n = 3), N (n = 4), dan seterusnya.
Nah, elektron yang mengisi setiap kulit ini rumusnya 2n2. Jadi, kalau Kulit K= 2n2 = 2 (1)2, maka maksimalnya 2 elektron. Sementara itu, kulit L= 2n2 = 2 (2)2 = 8 elektron maksimal, kulit M= 2n2 = 2 (3)2 = 18 elektron maksimal, kulit N= 2n2 = 2 (4)2 = 32 elektron maksimal, dan seterusnya.
Konfigurasi Subkulit (Kuantum)
Kalau konfigurasi yang satu ini berdasarkan kemungkinan adanya elektron pada subkulit atom, nih. Dalam subkulit, ada empat orbital, yaitu s, p, d, dan f.
Ada pula empat bilangan kuantum, yaitu bilangan kuantum utama (n) yang menunjukkan lintasan elektron dan tingkat energi elektron, bilangan kuantum azimuth (l) yang menunjukkan jenis orbital di subkulit, bilangan kuantum magnetik (m) yang menyatakan posisi orbital di subkulit, serta bilangan kuantum spin (s) yang menunjukkan posisi elektron di orbital.
Baca juga: Cek 19 Universitas Jurusan Kedokteran Terbaik di Indonesia!
Cara Menentukan Konfigurasi Elektron

Pada dasarnya, konfigurasi elektron adalah urutan angka yang menunjukkan letak elektron pada atom. Seperti yang telah kita ketahui, atom terdiri dari inti yang berisi proton dan neutron, serta lapisan elektron di sekelilingnya.
Konfigurasi elektron adalah bentuk visual dari letak elektron-elektron pada sebuah atom. Atom memiliki beberapa lapisan elektron atau orbital. Orbital merupakan tempat di mana satu atau lebih elektron dapat berpindah dengan aman terhadap gaya tarik oleh inti atom.
Hukum Pauli
Untuk mempermudah penentuan konfigurasi elektron, gunakan Hukum Pauli, yang menyatakan bahwa elektron-elektron memiliki nilai spin, yaitu +1/2 atau -1/2. Proses penentuan konfigurasi elektron terdiri dari beberapa langkah.
Langkah pertama adalah pengurutan unsur berdasarkan nomor atomnya dengan cara meningkatkan nilainya. Hal ini penting untuk mengetahui jumlah lapisan maksimum untuk atom, karena hanya ada empat lapisan orbital.
Kedua, cari jumlah valensi untuk unsur tersebut dengan referensi tabel periodik unsur. Valensi adalah jumlah elektron yang ditempatkan pada orbital terendah (orbital 1s).
Ketiga, tempatkan elektron-elektron secara berurutan ke orbital sesuai dengan hukum Pauli. Mulailah dengan memasukkan elektron pada orbital 1s dan lanjut ke orbital yang lebih tinggi sesuai urutan tabel. Untuk setiap tingkat lapisan orbital, abaikan satu elektron untuk nilai anggota spin +1/2 dan satu lagi untuk nilai spin -1/2.
Keempat, ulangi proses di atas sampai semua elektron telah tersebar pada orbital.
Terakhir, lihat tabel periodik untuk mencari tahu nomor atom dan simbol unsur yang terkait dengan atom.
ARTIKEL MENARIK LAINNYA:
- Pendaftaran CPNS 2023 Segera Dibuka | Simak Jadwal, Syarat, dan Cara Daftarnya!
- Cara Menabung untuk Beli Mobil Baru dalam Waktu Singkat, Ini Strateginya!
- Jangan Salah Pilih! Kenali Perbedaan Background Merah dan Biru pada Dokumen Resmi Negara
Itu dia pembahasan singkat tentang pengertian, jenis, dan cara menentukan konfigurasi elektron. Semoga mudah kamu pahami, ya!
Cari kost yang nyaman dan estetik sekarang gampang. Tinggal buka aplikasi atau kunjungi website Rukita, perusahaan proptech penyedia hunian sewa jangka panjang tepercaya dan antiribet. Tersebar di berbagai kota di Indonesia, tinggal di Rukita dijamin nyaman banget. Coba cek Rukita Clover Mangga Besar, deh.
Jangan lupa unduh aplikasi Rukita via Google Play Store atau App Store, atau kunjungi www.rukita.co. Mau cari info kost lainnya? Yuk, intip di Infokost.id!
Follow juga akun Instagram Rukita di @rukita_indo, Twitter di @rukita_id, dan TikTok di @rukita_id untuk berbagai info terkini serta promo menarik!
Bagikan artikel ini

